국내 식약처는 8월 29일 희귀암 유발 가능성이 제기된 엘러건사의 가슴보형물 말고도 모든 ‘거친 표면’ 가슴보형물을 사용 중지하기로 발표하였다.
식약처 관계자는 “엘러건을 제외한 다른 제품으로 수술한 케이스에서 아직 역형성 대세포 림프종이 발견된 사례는 없었지만, 부작용 예방 차원에서 전부 사용 중지를 하였다”라고 전했다.
‘텍스쳐드’ 가슴 보형물은 거친 표면이 특징인 보형물로 수년 간 ‘물방울 성형’에 주로 사용되었다.
물방울 성형은 ‘국내 여성의 인체에 최적화 된’ , ‘자연스러운 물방울 모양’ 이라는 문구로 많은 여성들에게 사랑받았으나, 정작 현재 많은 환자들은 물방울 성형 시 인체에 삽입된 보형물의 제품에 대해 정확한 제품명을 알지 못하는 것이 현 문제점이다.
이는 국내 최초 역형성 대세포 림프종 사례자가 발생됨에 따라 더욱 수술 시 사용된 가슴보형물에 대한 정보를 몰라 불안감에 떠는 환자들이 많아졌다.
가슴보형물을 이용한 가슴확대술을 받은 경우, 본인의 인체에 삽입한 가슴보형물에 정확한 정보와 수술을 받은 일자, 의료진 정보, 병원 정보 등을 보관하고 있어야 하지만 병원이 사라지거나,수술한 보형물의 제품명 및 정보를 알지 못하는 등이 실상이다.
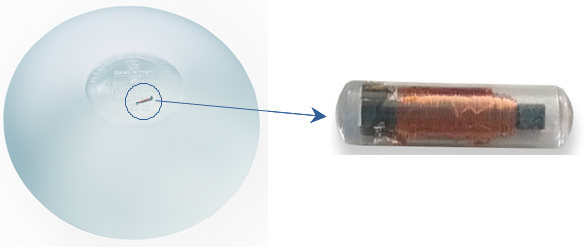
실리콘겔 인공유방 보형물은 의료기기 4등급으로 환자의 안전을 최대한 보장하기 위해 추적관리가 꾸준히 이루어져야 하는 의료기기이다.
해외의 UDI 동향을 보면 미국FDA는 UDI Guideline을 기반으로 지난 2013년 9월 UDI규정을 제정하고 의무화 하였으며, EU에서는 IMDRF의 UDI 가이드라인을 검토했으며, 2013년 EU차원의 UDI표준시스템안이 제안됐다.
모티바 코리아는 미국 FDA의 UDI Guideline을 기반으로 UDI_고유식별장치가 삽입된 실리콘겔 인공유방보형물 ‘모티바 어고노믹스 SIiksurface(스무스실크) with UDI Microtransponder’을 제공하고 있다.

